Le tavole periodiche
“Perché,” vi chiederete, “quante tavole periodiche ci sono?”
Ebbene sì. Non c’è solo la tavola periodica di Mendeleev che campeggia in tutte le scuole (o quasi), nei laboratori di ricerca e forse in molte case, come nella mia, quale poster da consultare spesso.
La tavola periodica degli elementi, così come la conosciamo oggi, è mostrata in figura:

È il risultato di studi e ricerche di molti scienziati a partire dal 1869, anno in cui Dmitrij Mendeleev, chimico russo, originario della Siberia, ultimo di diciassette figli, pubblicò il suo primo lavoro sull’argomento.
Probabilmente, quando gli studenti e le studentesse vedono la tavola per la prima volta provano le stesse sensazioni descritte da Charles Percy Snow (1905 -1980), scienziato e scrittore inglese:
“Nell’imparare la tavola per la prima volta vidi un miscuglio di dati casuali disposti in fila ordinata. Tutta la confusione e le formule e l’accozzaglia della chimica inorganica della mia adolescenza sembrarono disporsi ordinatamente secondo uno schema davanti ai miei occhi, come se uno si trovasse in prossimità di una giungla e improvvisamente questa si trasformasse in un giardino olandese.”
E il nostro Primo Levi (1919 – 1987), nel suo famoso libro “Il sistema periodico” (Einaudi, Torino, 1975) in cui gli elementi chimici sono il punto di partenza per raccontare storie e in qualche caso si personificano, scrive:
“Che vincere la materia è comprenderla, e comprendere la materia è necessario per comprendere l’universo e noi stessi: e che quindi il Sistema Periodico di Mendeleev, che proprio in quelle settimane imparavamo laboriosamente a dipanare, era una poesia, più alta e più solenne di tutte le poesie digerite in liceo: a pensarci bene, aveva perfino le rime!”
Vi immagino preoccupati! Vi tranquillizzo: questa non è una lezione di chimica! Brevemente descrivo i contenuti della tavola periodica, certamente senza riuscire a trasmettervi l’entusiasmo di Primo Levi che vedeva nella tavola “la più solenne di tutte le poesie”.
Vi sono rappresentati i 118 elementi attualmente noti: 92 sono naturali e 26 artificiali, prodotti cioè in laboratorio.
Nella tavola periodica, gli elementi sono ordinati, secondo il peso atomico crescente, in 7 righe orizzontali, numerate da 1 a 7 e chiamate periodi. Il sesto e settimo periodo contengono anche gli elementi riportati, per praticità, nella parte inferiore della tavola periodica, in modo da rappresentarla in forma compatta; questi due blocchi di elementi sono chiamati lantanoidi e attinoidi perché si trovano, rispettivamente, dopo il lantanio e dopo l’attinio. Gli elementi sono inoltre divisi in 18 colonne verticali, chiamate gruppi e numerate da 1 a 18. I gruppi riuniscono elementi che presentano un comportamento chimico simile.
La tavola pubblicata da Mendeleev elencava solo i 63 elementi allora noti e sia nella versione pubblicata nel 1869 che in quella pubblicata nel 1871 lo scienziato aveva lasciato dei posti vuoti con punti interrogativi.

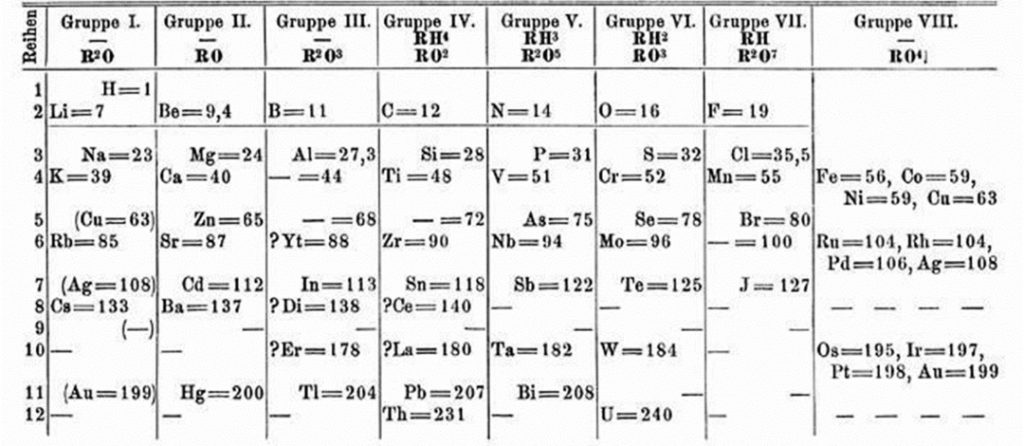
Mendeleev aveva ordinato gli elementi secondo il peso atomico crescente e incolonnato nello stesso gruppo elementi che avevano le stesse proprietà chimiche: dopo più di 150 anni, l’attuale tavola periodica che contiene quasi il doppio degli elementi noti a Mendeleev è organizzata secondo le medesime idee! E Mendeleev non conosceva la struttura dell’atomo che ha fatto chiarezza sul ripetersi, in modo periodico, delle proprietà chimiche degli elementi. Lo scienziato russo aveva notato che alcuni posti rimanevano vuoti ma intuì che questi sarebbero stati occupati da elementi non ancora scoperti e ne predisse le proprietà. Mendeleev previde in particolare la presenza di due elementi, uno sotto l’alluminio e l’altro sotto il silicio che chiamò provvisoriamente eka-alluminio e eka-silicio (eka prefisso sanscrito che significa «uno» o «simile a uno»). Dopo sei anni dalle previsioni di Mendeleev fu isolato il gallio che aveva le caratteristiche, con minime discrepanze, dell’elemento che lo scienziato aveva chiamato eka-alluminio.
Alcuni storici raccontano (ma sarà vero???) che l’idea di riordinare gli elementi allora noti gli era venuta per la necessità di dare un ordine a questi nella descrizione che ne faceva nei libri di cui era autore. Sembra che avesse scritto, per ciascuno degli elementi, delle schede e che le disponesse in un certo ordine come carte di un solitario. Altri storici parlano del 17 febbraio 1869 come del “giorno dell’illuminazione”, giorno in cui cancellò la visita ad un caseificio in veste di consulente e decise di lavorare a casa alla sua idea. Qualche altro storico parla anche di “un sonnellino ristoratore” durante il quale sognò la soluzione.
Ma veniamo alle altre tavole periodiche.
In occasione dell’Anno Internazionale della tavola periodica, nel 2019, l’European Chemical Society (EuChemS), organizzazione europea senza scopo di lucro che promuove la collaborazione tra società tecnico-scientifiche, ha progettato un nuovo tipo di tavola periodica con l’obiettivo di invitare tutti a riflettere sulla scarsità di molti elementi chimici, al fine di evitarne gli sprechi. La tavola è stata completamente ridisegnata in modo che l’area occupata da ciascun elemento rappresenti la sua abbondanza (aree più grandi rappresentano una maggiore abbondanza) e il colore ne identifichi la disponibilità.
Il rosso colora le aree di elementi di cui attualmente si fa un così grande consumo da renderli poco disponibili in 100 anni o meno. Questi gli elementi in pericolo: elio (He), argento (Ag), tellurio (Te), gallio (Ga), germanio (Ge), stronzio (Sr), ittrio (Y), zinco (Zn), indio (In), arsenico (As), afnio (Hf) e tantalio (Ta).
Il giallo e l’arancione sono i colori delle aree degli elementi che evidenziano criticità ma non così elevate come per gli elementi collocati in aree colorate di rosso.
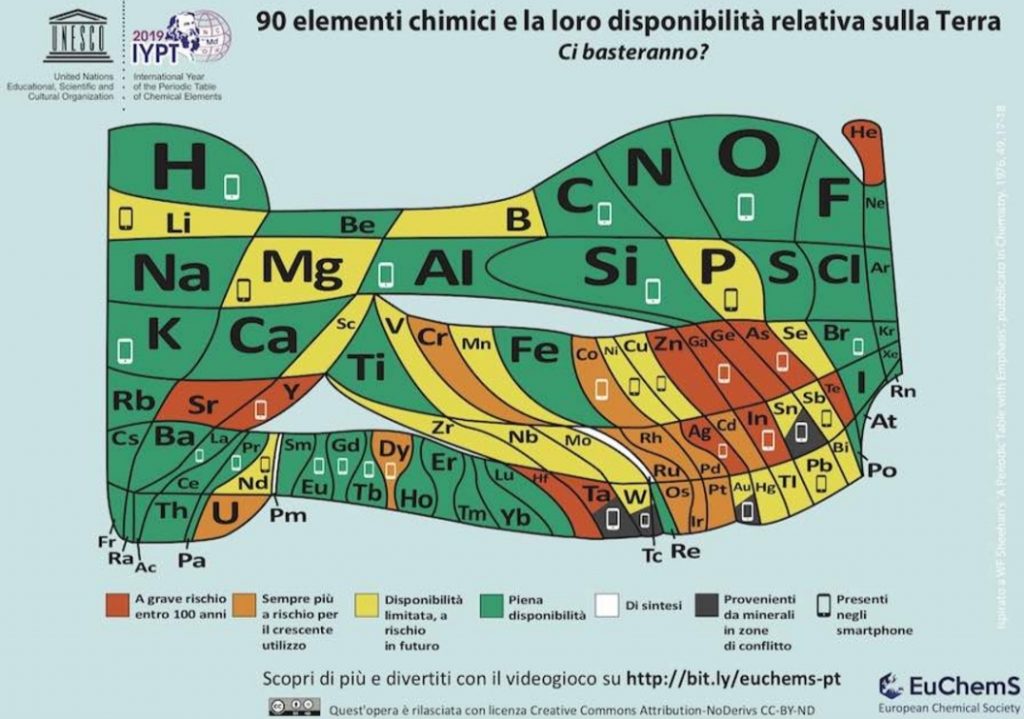
Il verde colora le aree degli elementi di cui c’è ancora molta disponibilità come per ossigeno (O), idrogeno (H), alluminio (Al), calcio (Ca) ed altri.
Quattro elementi – stagno (Sn), tantalio (Ta), tungsteno (W) e oro (Au) – sono in aree colorate di nero perché spesso si ricavano da minerali provenienti da zone di conflitto, cioè dalle miniere di paesi dove si combattono le guerre per la loro proprietà.
A 30 dei 90 elementi è associato un simbolo di smartphone, perché questi elementi sono tutti contenuti in questi dispositivi. Tra questi ci sono i quattro gli elementi provenienti da minerali estratti in zone di conflitti e altri sei con una vita utile prevista inferiore a 100 anni.
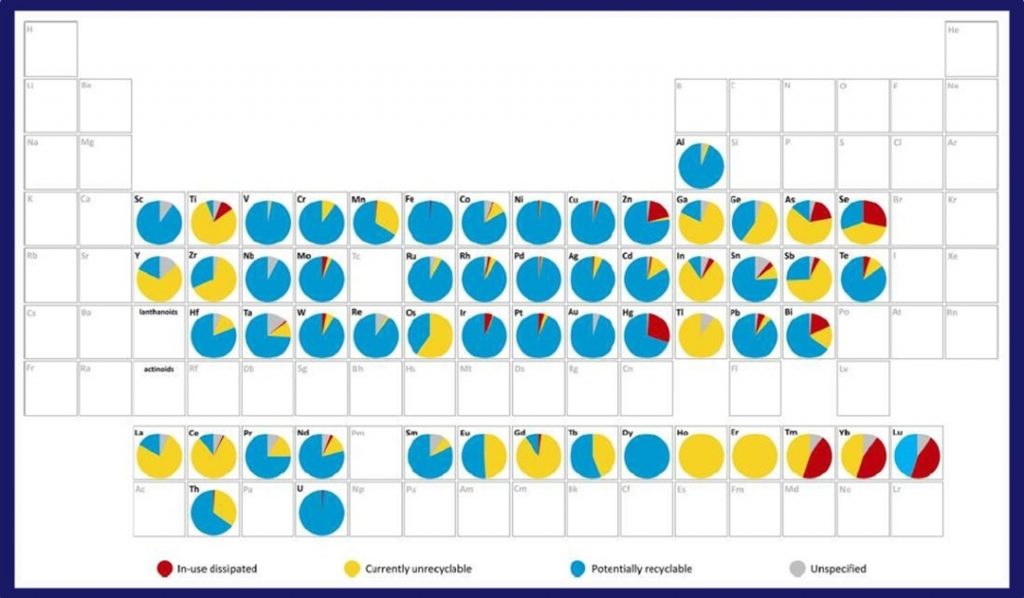
E la tavola del riciclo ci ricorda inoltre che non tutti i materiali sono riciclabili: un ulteriore ammonimento a limitare gli sprechi.
C’è poi una tavola periodica storica prodotta su una iniziativa didattica dell’università di Waterloo (Canada).
In occasione dell’Anno Internazionale della Tavola Periodica, l’università ha bandito un concorso rivolto a studenti di tutto il mondo. Si chiedeva di rappresentare gli elementi della tavola periodica in un esagono. Le opere migliori compongono questa tavola periodica in cui gli elementi sono ordinati tenendo conto delle date in cui sono stati scoperti. Hanno partecipato studenti di 118 scuole di 28 paesi.
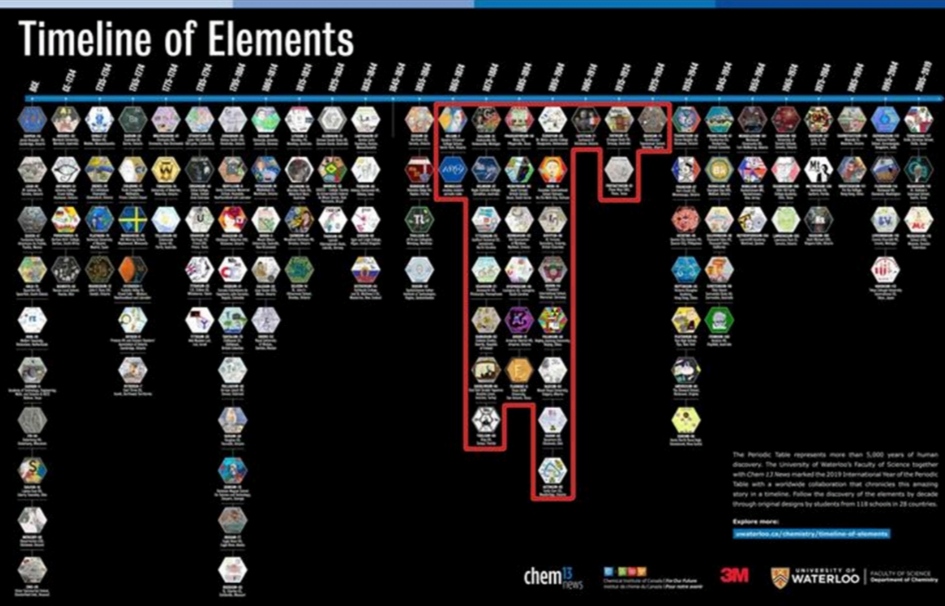
Di seguito alcune immagini delle opere realizzate da studenti.


L’armonia, l’eleganza, la bellezza poetica, il grandissimo valore scientifico della tavola periodica sono il risultato di 150 anni di studi, per questo mi piace concludere questo articolo con una frase tratta dal libro “In un volo di storni. Le meraviglie dei sistemi complessi” (Rizzoli, Milano, 2021) del premio Nobel per la fisica 2021 Giorgio Parisi:
«In fisica e in matematica è impressionante la sproporzione tra lo sforzo per capire una cosa nuova per la prima volta e la semplicità e naturalezza del risultato una volta che i vari passaggi sono stati compiuti. Nel prodotto finito, nelle scienze come in poesia, non c’è traccia della fatica del processo creativo e dei dubbi, delle esitazioni che lo accompagnano.»
Ernesta De Masi.




